Коллега, ранее Вы предложили рассматривать полуволну как корпускулу, имеющую конкретный размер (длина полуволны), энергию, импульс и массу.
Минуточку, мой друг. Это французский физик Луи де Бройль в 1923 году пришёл к выводу, что с движущейся частицей можно связать распространяющуюся волну, длина которой λ = h/p (h – постоянная Планка), а её импульс p = mv (m – масса частицы-полуволны, v – скорость распространения волны). Он даже высказал (казавшуюся тогда сумасшедшей) идею о том, что и электрон обладает волновыми свойствами.
Теперь известно, что электромагнитные волны существуют лишь в виде дискретных порций энергии, называемых фотонами. Поведение каждого фотона, или кванта энергии, очень похоже на поведение частицы. Это касается и электрона. Идея о волновых свойствах электрона получила развитие в работах австрийского физика Эрвина Шредингера, английского физика Поля Дирака, немецких физиков Вернера Гейзенберга и Макса Борна. Опытное подтверждение эта идея получила в 1927 году, когда было открыто явление дифракции электронов.
Атом стали рассматривать уже как ядро, вокруг которого расположены стоячие волны, а амплитуду волн – как вероятность нахождения электрона в данном месте. Причём, движение электрона считали устойчивым только тогда, когда вдоль орбиты укладывается целое число стоячих волн.
Коллега, и что нам дают эти волны де Бройля?
Волны де Бройля позволяют не только наглядно представить квантовую структуру поля, но и обосновать закономерность заполнения электронных оболочек атома. Заметьте, ОБОСНОВАТЬ принцип периодичности таблицы Менделеева.
Но, коллега, разве этот принцип ещё не обоснован?
Решающую роль в понимании закономерности заполнения электронных оболочек атома сыграл принцип Паули (принцип запрета), сформулированный им в 1925 году в процессе исследования аномального эффекта Зеемана. Согласно этому принципу, две тождественные частицы с полуцелым спином не могут одновременно находиться в одном состоянии, то есть, количество электронов, которые могут располагаться на одной электронной оболочке атома, ограничено.
Применение принципа Паули привело к новой (фермиевской) статистике для электронного газа, объясняющей большинство тепловых, электрических и магнитных свойств твёрдого тела. В 1945 году Паули был удостоен Нобелевской премии.
Теперь же с помощью волн де Бройля мы можем понять, как изменяется атомная структура при переходе от простейшего атома водорода к более сложным атомам.
Коллега, Вы можете пояснить это на конкретном примере?
Конечно же, мой друг. Для этого проведём не совсем обычный опыт.
Закрепим (см. рис. 1) один конец резиновой трубки к неподвижной опоре (точка d), а другой её конец (точка а) начнём колебать в вертикальной плоскости. В результате мы увидим, как по нашей трубке побежит волна. Если частоту колебаний подобрать так, чтобы на расстоянии (l) от места колебания до неподвижной опоры укладывалось целое число (n = 1,2,3...) полуволн (λ/2), то отражённые от опоры колебания, зеркально повторяя приходящие и, пересекаясь с ними в узлах a, b, c, d, образуют стоячие волны.
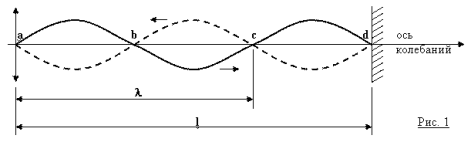
Вывод 1. Стоячие волны на отрезке l образуются, если соблюдается условие:
l = nλ/2 или 2l = nλ.
Теперь плоскость распространения волны мысленно свернём в кольцо (подробнее см. «Дополнение» здесь). В этом и заключается необычность нашего опыта. Теперь волна уже не может отразиться от неподвижной опоры, а бесконечно обегает окружность с радиусом r (например, в оболочке атома).
При этом, выявляется принципиальная особенность – картина стоячих волн сохраняется только в том случае, если колебания, проходящие чётный по счёту круг, зеркально повторяют (находятся в противофазе) колебания на предыдущем нечётном круге.
Данное условие соблюдается, если по окружности укладывается целое, но обязательно нечётное число (n = 1, 3, 5...) полуволн (λ/2).
Дополнение. Для образного восприятия можно нарисовать волну на узкой полоске бумаги и затем свернуть эту полоску в кольцо так, чтобы рисунок остался на внешней стороне кольца, а начало и конец волны совпали в одной точке (назовём её точкой совпадения).
Сначала разберём случай, когда в кольцо свёрнута только одна полуволна (в точке совпадения оказались узлы a и b).
В этом случае волна, сделав первый оборот по окружности, приходит к точке совпадения сверху вниз и, двигаясь дальше, образует зеркальное своё отражение ниже оси колебаний. При втором пересечении точки совпадения волна устремляется уже снизу вверх и далее повторяет свой первоначальный путь выше оси колебаний. Затем снова она движется, ниже этой оси и так до бесконечности.
Следует заметить, что волна ни от чего не отражается. Она движется только вперёд, но эффект стоячей волны есть. В этом случае мы имеем две пучности в противофазе и один узел, которым является точка совпадения.
Теперь свернём в кольцо две полуволны, то есть – полную волну (в этом случае совпадают уже узлы a и c). Теперь волна, проходя после первого круга точку совпадения, устремляется снизу вверх и далее вновь по своему первоначальному пути, нигде его не пересекая. Узлов нет. Пучностей в противофазе – тоже. Эффект стоячей волны не наблюдается.
Далее проводим опыт уже с тремя полуволнами (теперь совпадают узлы a и d). И мы вновь видим, что волна, проходя первый круг, пересекает в точке совпадения свой первоначальный путь и опять образует узлы и пучности в противофазе. В этом случае эффект стоячей волны тоже есть.
Увеличивая и дальше в наших опытах число полуволн, нетрудно убедиться, что стоячие волны образуются в кольце с радиусом r, если длина окружности 2πr содержит целое, но только нечётное число полуволн.
Вывод 2. Стоячие волны в круговом пространстве с радиусом r имеют место, если
4πr = (2n-1)λ.
Ещё шаг вперёд. Выясним, сколько пучностей можно насчитать при различных значениях n? Для этого обратимся к рисунку 2, где изображены два вида волн – первой и третьей гармоник (чётных гармоник, как мы уже знаем, быть не может).
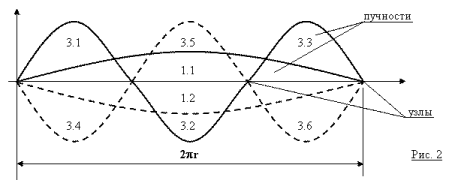
Волна первой гармоники имеет только две пучности (1.1 и 1.2), волна третьей – шесть (3.1 – 3.6). Легко убедиться, что волна пятой гармоники имеет 10 пучностей, а седьмой – 14.
Ведущая идея. Главное квантовое число n показывает, сколько гармоник имеется на данной круговой орбите, или иными словами – в данной оболочке.
Тогда, при:
• n = 1 имеем одну гармонику (первую) и только 2 пучности;
• n = 2 имеем две гармоники (первую и третью) и 2 + 6 = 8 пучностей;
• n = 3 имеем три гармоники (первую, третью и пятую) и 2 + 6 + 10 = 18 пучностей;
• n = 4 имеем четыре гармоники (первую – седьмую) и 2 + 6 + 10 + 14 = 32 пучности.
Вывод 3. В оболочке с квантовым числом n может быть n видов стоячих волн с суммарным числом пучностей или состояний ∑2(2ni-1) = 2n2.
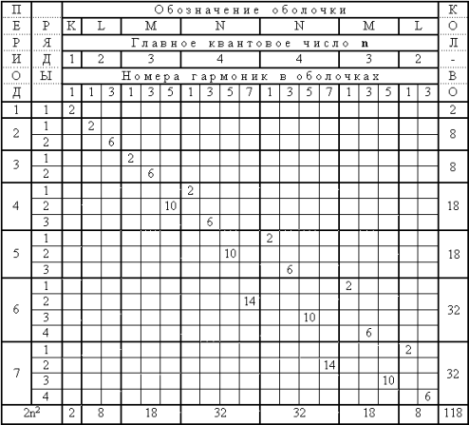
Этот принцип лежит в основе периодичности свойств чистых элементов (см. таблицу):
Число состояний в оболочках (назовём их K, L, M, N) соответственно составляет 2, 8, 18 и 32, а количество элементов в каждом периоде – 2, 8, 8, 18, 18, 32, 32 – всего 118 элементов. Порядок заполнения электронных оболочек в атоме определяется следующими условиями:
Первое. В системе атома может существовать не более семи оболочек с главными квантовыми числами, соответственно,
n = 1, n = 2, n = 3, n = 4, n = 4, n = 3 и n = 2.
Второе. Внутри каждой отдельно рассматриваемой оболочки образуется сначала первая, затем третья и далее все более высокие гармоники по числу n.
Пример: В оболочке с n = 3 сначала образуется первая, затем третья и лишь потом пятая гармоники.
Третье. Любая гармоника в интересующей нас оболочке образуется только после формирования следующей по счету гармоники в предыдущей оболочке.
Пример: 3-я гармоника в 5-ой оболочке появится, если уже существует 5-я гармоника в 4-ой оболочке.
Эти правила вытекают из фундаментального закона Природы – периодической системы элементов Дмитрия Ивановича Менделеева, которую он впервые опубликовал в 1869 году. «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от их атомного веса» – такую классическую формулировку дал Менделеев периодическому закону в 1871 году. Она соответствует химическому этапу в развитии менделеевского учения о периодичности.
На смену ему пришёл этап физический. Теперь мы убеждены, что свойства элементов, простых веществ и их соединений находятся в периодической зависимости от появления новых волновых оболочек, количества в них гармоник и, соответственно, от числа пучностей или состояний (см. таблицу).
Более того, теперь мы можем определить последний элемент в периодической таблице Менделеева (назовём его Va – «Valenta») с атомным номером 118 и атомной массой 298. Это тяжёлый инертный газ с металлическими свойствами и температурами плавления 240оК и испарения – 250оК.
На главную
|









